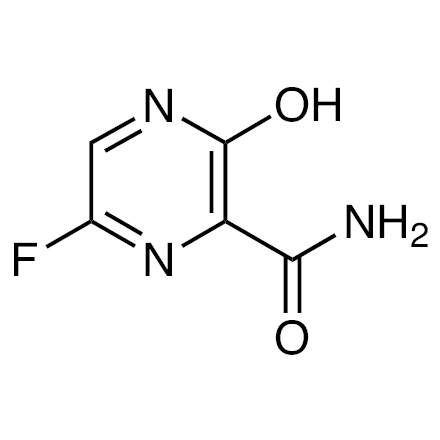
ファビピラビルの概要

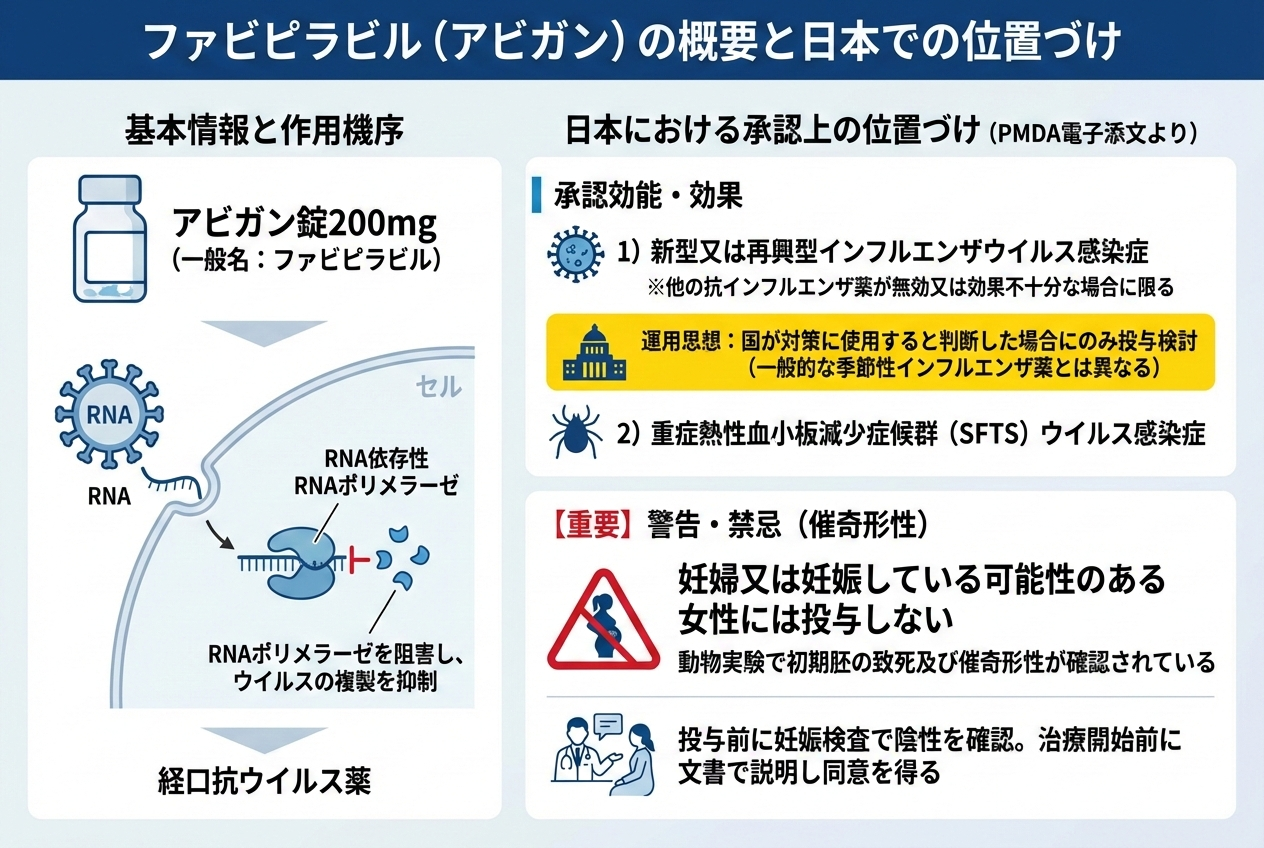
ファビピラビルは、RNAウイルスの複製に必須の酵素であるRNA依存性RNAポリメラーゼを標的とする経口の抗ウイルス薬です。
国内では代表製剤としてアビガン錠200mgが知られています。
ファビピラビルの作用機序

ファビピラビルは体内でそのまま効く薬ではなく、細胞内で代謝されて活性体になった後に抗ウイルス作用を発揮します。
作用の流れ
細胞内へ取り込まれる
↓
細胞内酵素により活性体へ変換
↓
活性体がRdRpの基質として認識され、RdRp活性を阻害
↓
ウイルスRNA複製が抑制され、増殖が抑えられる
日本と海外での位置づけの違い
日本における承認上の位置づけ
PMDAの電子添文(アビガン錠200mg)では、効能・効果として以下が記載されています。
- 新型又は再興型インフルエンザウイルス感染症
(ただし、他の抗インフルエンザウイルス薬が無効又は効果不十分なものに限る)
- 重症熱性血小板減少症候群(SFTS)ウイルス感染症
また、新型又は再興型インフルエンザに対しては、「国が対策に使用すると判断した場合にのみ投与が検討される」旨の注意が明記されており、一般的な季節性インフルエンザ治療薬とは運用の想定が異なります。
海外での使用例
ファビピラビルはCOVID-19流行期に各国で臨床使用・研究対象となった例があります。
ただし、国や地域によって承認状況や使用条件は異なります。
※海外での取り扱いが日本での使用や有効性を保証するものではありません。
ファビピラビルを有効成分とする代表的な医薬品
日本で承認されている医薬品
| アビガン錠200mg |
|---|
 |
| ファビピラビル含有量:200mg/錠 |
| 製造元:富士フイルム富山化学株式会社 |
ジェネリック医薬品
| フェラビル – ファビピラビル |
|---|
  |
| ファビピラビル含有量:200mgまたは400mg |
| 製造元:キセノンファーマ |
| 商品ページはこちら |
使い方
 ※ここでは電子添文に基づく一般的情報を示します。実際の投与は必ず医師の指示に従ってください。
※ここでは電子添文に基づく一般的情報を示します。実際の投与は必ず医師の指示に従ってください。
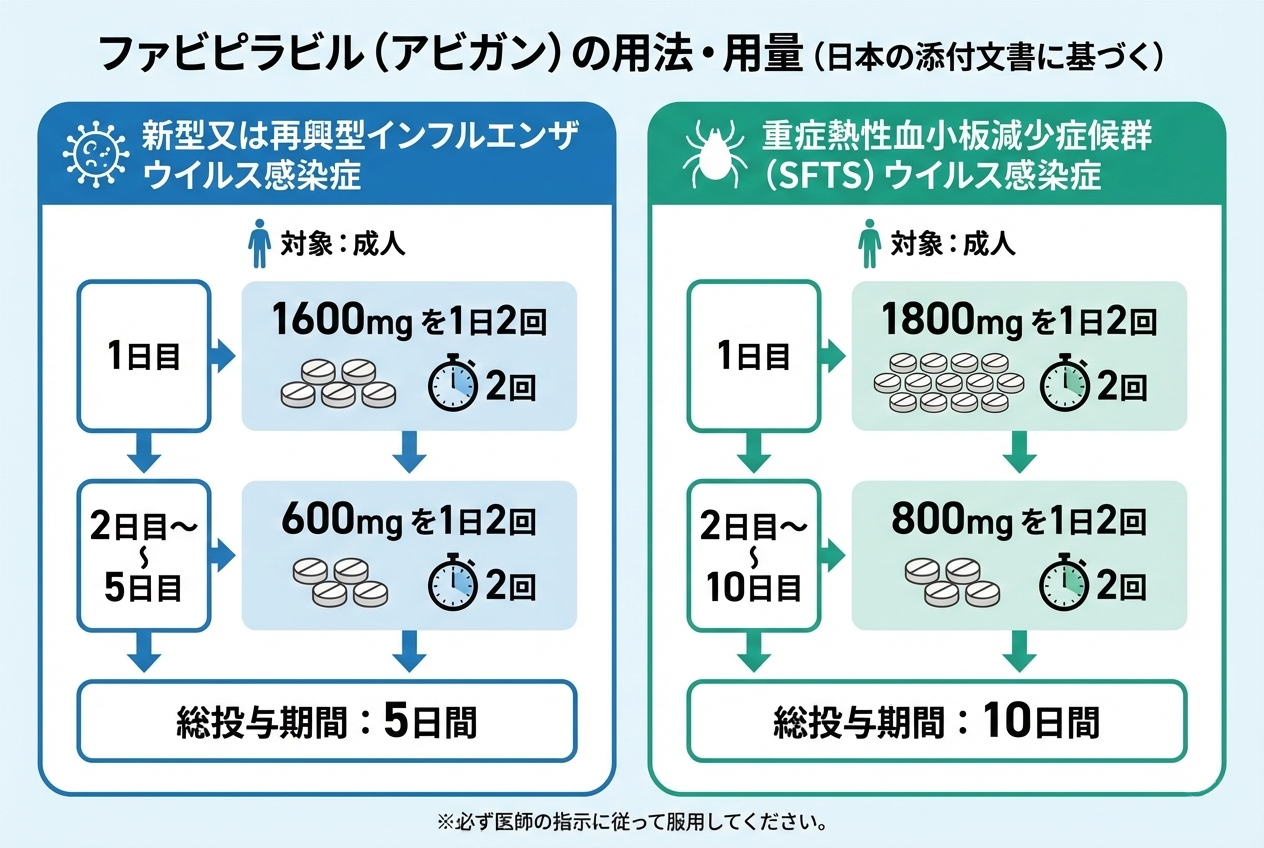
日本の添付文書に基づく用法用量
新型又は再興型インフルエンザウイルス感染症
- 通常、成人:1日目 1600mg を1日2回
- 2日目~5日目:600mg を1日2回
- 総投与期間:5日間
重症熱性血小板減少症候群(SFTS)ウイルス感染症
- 通常、成人:1日目 1800mg を1日2回
- 2日目~10日目:800mg を1日2回
- 総投与期間:10日間
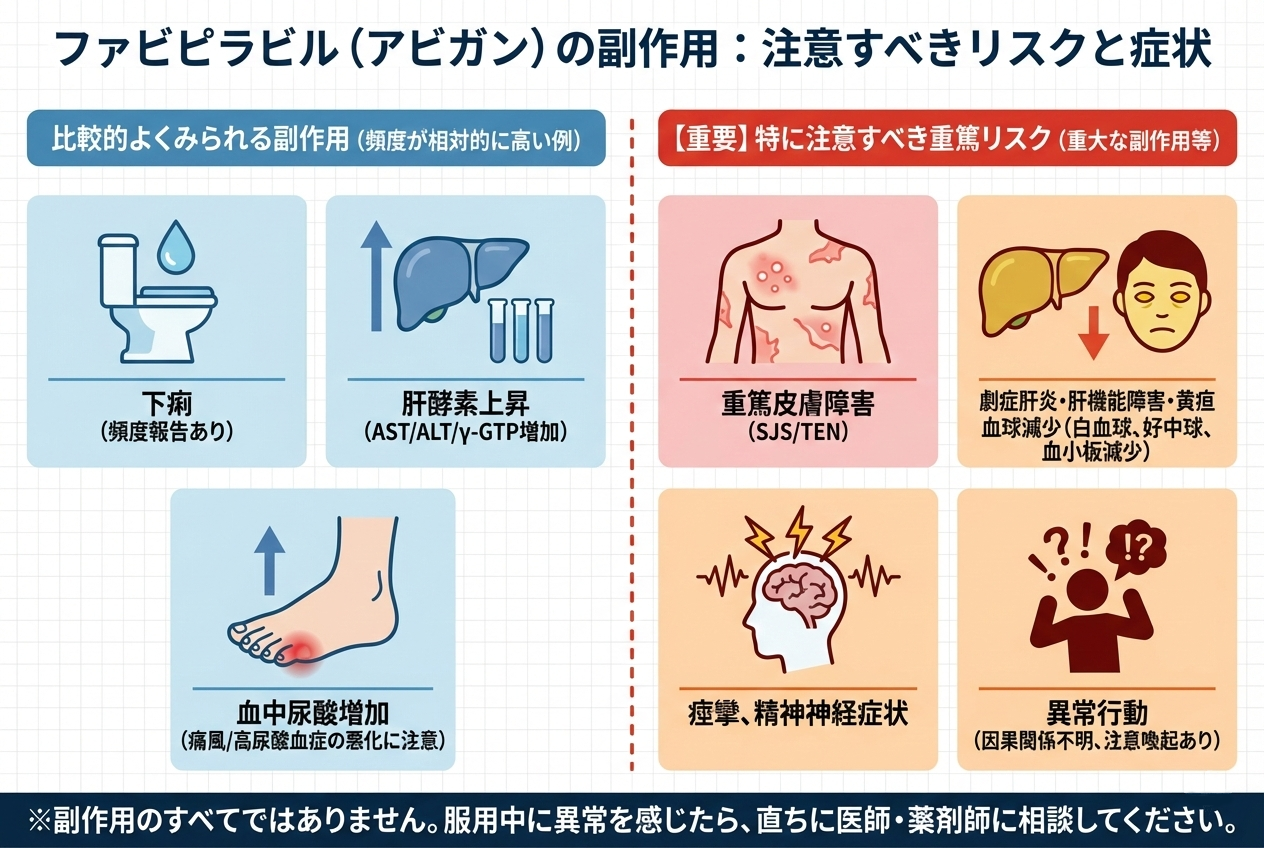
ファビピラビルの副作用

副作用は軽微なものから重篤なものまで幅があります。
比較的よくみられる症状
- 下痢
- 肝酵素上昇(AST/ALT/γ-GTP増加)
- 血中尿酸増加(高尿酸血症):痛風/高尿酸血症の患者で悪化し得る注意
特に注意すべき重篤な症状
- 重篤皮膚障害(SJS/TEN)
- 劇症肝炎・肝機能障害・黄疸
- 血球減少(白血球減少、好中球減少、血小板減少)
- 痙攣、精神神経症状
- 異常行動(因果関係は不明としつつ注意喚起)
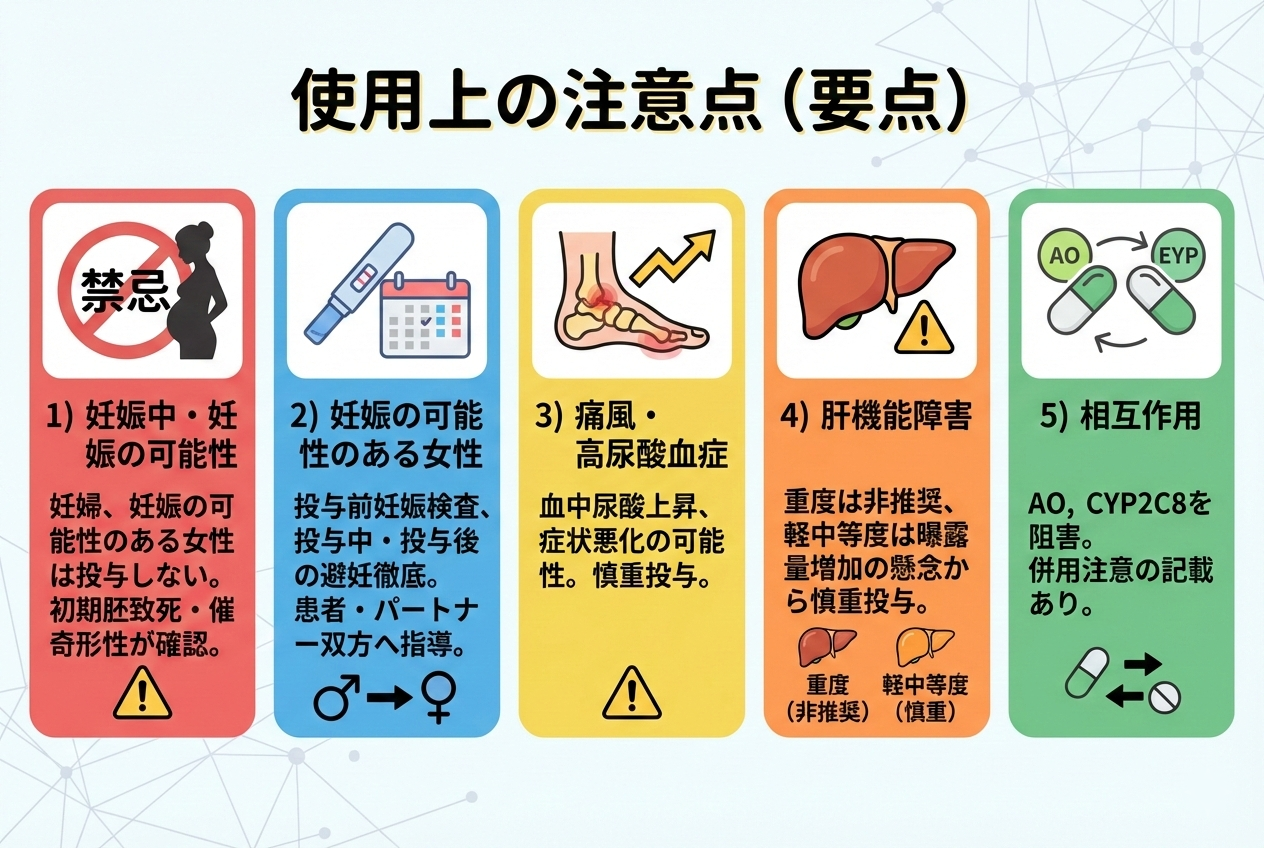
使用上の注意点

1) 妊娠中(または妊娠の可能性)のある女性には投与しない(禁忌)
電子添文では、動物実験で初期胚致死・催奇形性が確認されているとして、妊婦または妊娠している可能性のある女性は禁忌と明記されています。
2) 妊娠する可能性のある女性への投与時:妊娠検査と避妊徹底
投与開始前の妊娠検査、投与期間中および投与終了後一定期間の極めて有効な避妊について、患者・パートナー双方への指導が求められています。
3) 痛風・高尿酸血症
血中尿酸が上昇し、症状が増悪し得るため慎重投与の対象です。
4) 肝機能障害
重度肝機能障害では投与が推奨されない旨、軽中等度でも曝露量増加の懸念から慎重投与が記載されています。
5) 相互作用
ファビピラビルは主にAO、部分的にXOで代謝され、AOやCYP2C8を阻害する旨が記載されています。また併用注意の記載があります。
入手方法
日本ではアビガンは処方箋医薬品であり、適応や運用(特に新型/再興型インフルの条件付き性格、SFTSでの体制要件等)は電子添文・行政運用に沿って判断されます。ただし、フェラビルは個人輸入で海外からの購入が可能です。
まとめ
ファビピラビルは、細胞内で活性化された後にRdRpを阻害してRNAウイルスの複製を抑える経口抗ウイルス薬です。
日本の電子添文上、新型/再興型インフルエンザ(他薬無効/不十分に限定)およびSFTSが効能・効果として記載されています。
安全性では、妊娠禁忌と避妊の徹底が最重要論点であり、加えて高尿酸血症、肝機能障害、重篤皮膚障害、血球減少、痙攣・精神神経症状等に留意が必要です。
参照:
ファビピラビル(T-705):臨床微生物学会
アビガン錠200mgの基本情報:日経メディカル
アビガン:kegg